Шарлов закон
Овај закон се добија када претпоставимо да је запремина гаса стална (V=const). При овој промени стања мењају се температура и притисак гаса. Промена стања гаса при сталној запремини назива се изохорска промена стања или изохорски процес.
Француски физичар Шарл (у 18. веку) је први експериментално утврдио правилност у понашању гаса при изохорском процесу.
При сваком загревању брзина молекула се повећава. Ако се при томе запремина гаса (односно посуде у којој се гас налази) не мења, молекули ће све чешће и све јаче ударати у зидове посуде, чиме се повећава притисак гаса на зидове посуде.
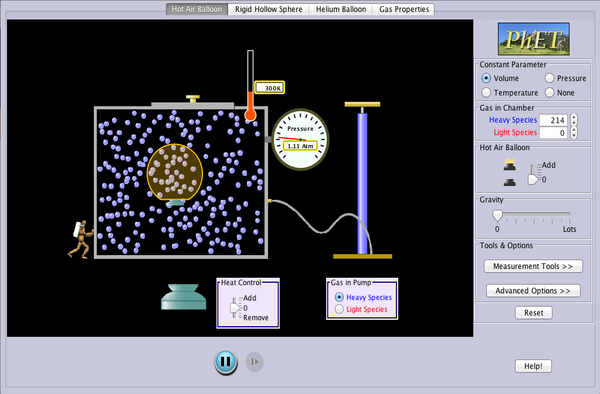
Гас се налази у затвореној посуди која је спојена са манометром. Посуда са гасом је постављена у посуду са водом која може да се загрева.
У посуду са водом се дода довољна количина леда, тако да ће након одређеног времена температура воде у посуди, а и темепартура гаса бити 00C. Притисак гаса, који а одговара овој темепратури обележићемо са p0. Постепеним загревањем посуде са водом, повећаваће се температура, а самим тим и притисак гаса. Притисак гаса на некој темпeрaтути t означићемо са p.
промена притиска: ![]()
промена температуре: ![]()
Промена притиска сталне количине гаса при сталној запремини сразмерна је промени температуре и притиску на 00C.
![]()
![]()
где је:
p – притисак гаса на некој температури t
p0 – притисак гаса на 00C
![]()
![]()
Шарлов закон:
У посуди константне запремине, притисак сталне количине гаса зависи од темепературе по закону:
![]()
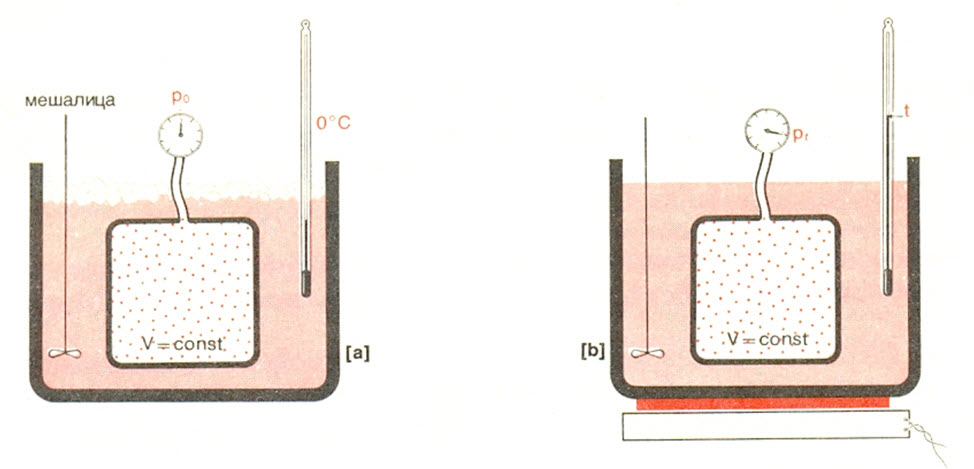
График зависности изохорске промене притиска у p-t координатном систему:
Права која показује зависност притиска гаса од температуре при сталној запремини назива се изохора. Мерења не могу да се врше на ниским температурама, јер гас тада прелази у течно стање, али ако се експериментално добијена права продужи види се да она пресеца хоризонталну осу у температури апсолутне нуле. Што би значило да би на апсолутној нули притисак гаса био једнака нули, а испод те температуре би био негативан. Притисак гаса не може да буде негативан – то показује да је најнижа могућа температура једнака апсолутној нули.
Процес може да се понавља са истом количином гаса у посудама различитих запремина. Добијају се другачије вредности притиска, али се продужеци свих изохора такође секу у тачки апсолутне нуле. Нагиб изохоре зависи од вредности запремине на којој се одвија процес.
Шарлов закон изражен преко апсолутне температуре:
![]()
![]()
![]()
![]()
![]()
Шарлов закон:
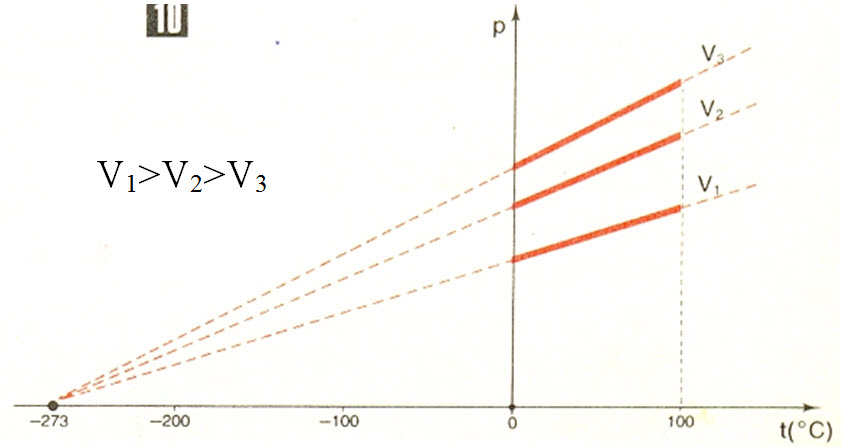
Количник притиска и апсолутне темпаратуре сталне количине гаса у изохорском процесу је константан.
![]()
![]()
График зависности (p-T):
До истог закључка можемо да дођемо и анализом једначине стања идеалног гаса:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Додатак: